Leyes de los gases
En este tema vamos a estudiar tres leyes:
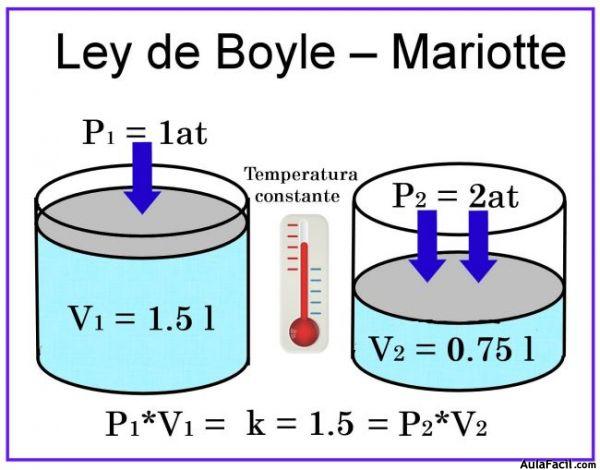
- Ley de Boyle-Mariotte: el volumen de una cantidad fija de un gas mantenido a temperatura constante es inversamente proporcional a la presión del gas (Chang, R., 2006).
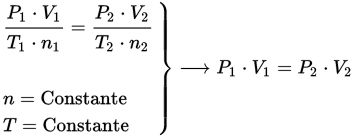
EJEMPLO
1.- Un globo inflado tiene un volumen de 0.549 L a nivel del mar (1 atm) y se deja elevar a la altura de 6.6 km, donde la presión es de unos 0.40 atm. Considerando que la temperatura permanece constante, ¿cuál es el volumen final del globo?
Primero analizamos los datos que tenemos:
V1 = 0.549 L
P1 = 1 atm
P2 = 0.40 atm
V2 = ?
Realizamos el despeje y procedemos a sustituir los datos del problema para encontrar el volumen 2:

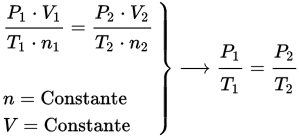
- Ley de Charles: el volumen de una cantidad fija de gas mantenida a presión constante es directamente proporcional a la temperatura absoluta del gas (Chang, R., 2006).
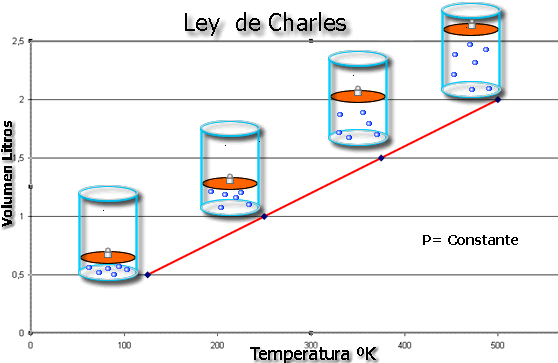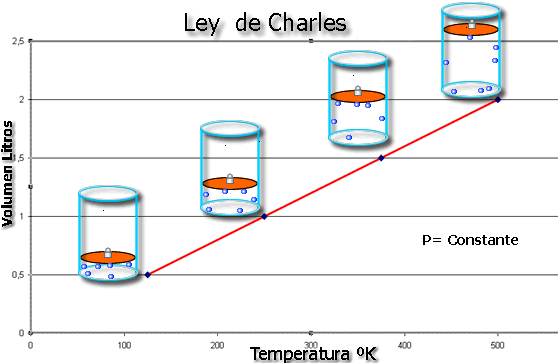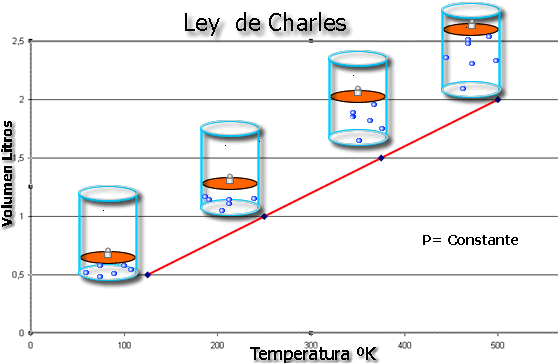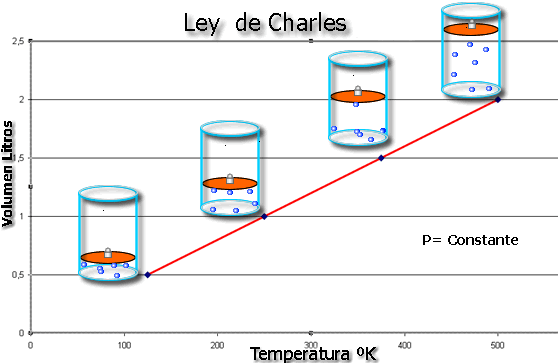
EJEMPLO
1.- El argón es un gas inerte usado en los tubos luminosos. En un experimento, 450 mL de gas se calientan de 23°C a 188°C a presión constante. ¿Cuál es el volumen final?
Analizamos los datos que tenemos, procedemos a realizar el despeje y sustituir los datos, aquí debemos resaltar que las temperaturas estén en la escala absoluta (K):
V1 = 450 mL
T1 =23 + 273= 296 K
T2 = 188 + 273 = 461 K
V2 = ?

- Ley de Avogadro: a presión y temperatura constantes, el volumen de un gas es directamente proporcional al número de moles del gas presente (Chang, R., 2006).
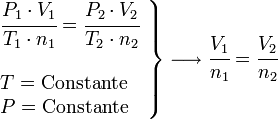
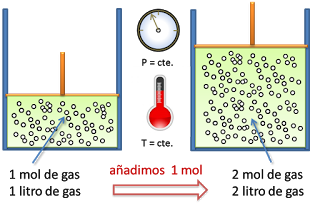
1.- ¿Cuál es la masa de 9.88 L de CO2 en condiciones normales de volumen (1 mol = 22.4 L de cualquier gas.
Lo primero que tenemos que ver es que nos piden la masa del gas, por lo cual primer tenemos que conocer los moles; eso lo conoceremos por la ley de Avogadro.
Analizamos los datos con los que contamos, para proceder a despejar y sustituir datos:
V1= 22.4 L
V2 = 9.88 L
n1 = 1 mol
n2 = ?

ACTIVIDAD. Resuelve los siguientes problemas.
a) Una muestra de cloro gaseoso ocupa un volumen de 945 mL a una presión de 725 mm Hg. Calcule la presión del gas si el volumen se reduce a 154 mL. Supóngase que la temperatura se mantiene constante.
|
b) Una muestra de monóxido de carbono, un gas venenoso, ocupa 3.19 L a 126°C. Calcule la temperatura a la cual el gas ocupará 1.55 L, si la presión permanece constante.
|
c) ¿Qué volumen ocupan 1 millón (1x106 ) de moléculas de gas Hidrógeno, H2, en condiciones normales de presión y temperatura (1 atm; 273 K)?
|