Ecuación de los gases ideales.
Con esta ecuación podemos conocer alguna de las siguientes medidas: presión, volumen, moles o temperatura, siempre y cuando tengamos conocimiento de los demás datos. Además, también necesitamos la Constante general de los gases (R) que, para efecto de este curso, vamos a utilizar la de 0.0821 atm*L/mol*K, pero existe más:

La ecuación general de los gases ideales es la siguiente:

Además, debido a que n= m/M (moles es igual a la masa entre la masa molar), podemos obtener esos datos también mediante la siguiente ecuación:
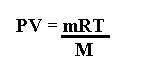
La densidad es p = m/v, por lo cual también la podemos obtener con la ecuación:
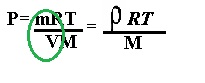
EJEMPLO
1.- El hexafloururo de azufre (SF6) es un gas incoloro, inodoro y muy reactivo. Calcular la presión (en atm) ejercida por 1.9 moles del gas en un recipiente con 5.45 L a 70°C.
n= 1.9 moles
V= 5.45 L
T= 70 + 273 = 343 K
R= 0.0821 atm*L/moles*K
P= ?

2.- Calcular el volumen (en litros) ocupado por 7.50 g de CO2 a T.P.E. (temperatura y presión estándar: 273 K y 1 atm).
m= 7.50 g de CO2
V= ?
T= 273 K
R= 0.0821 atm*L/moles*K
P= 1 atm
M= 44 g/n

3.- Calcule la densidad del amoniaco (NH3) en gramos por litro (g/L) a 755 mm Hg y 60°C.
P = 755 mm Hg
Esa presión, tenemos que convertirla a atmósferas:

M= 17 g/n
R= 0.0821 atm*L/moles*K
T= 60 + 273 = 333 K
Procedemos a hacer el despeje y sustituir los datos:

ACTIVIDAD. Resolver los siguientes problemas.
a) Una muestra de nitrógeno gaseoso se guarda en un recipiente cuyo volumen es de 2.4 L y a una temperatura de 30°C ejerce una presión de 4.5 atm. Calcule el número de moles de gas.
|
b) Una cantidad de gas que pesa 7.00 g ocupa un volumen de 5.50 L a 740 torr y 45°C. ¿Cuál es su masa molar?
|
c) Las moléculas de ozono presentes en la estratósfera absorben buena parte de la radiación solar que daña a los seres humanos. La temperatura y presión típicas del ozono son 255 K y 1.0X10-3 atm, respectivamente. ¿Cuántas moléculas de ozono están presentes en 2.0 L de aire en estas condiciones?
|
d) Calcule la densidad del bromuro de hidrógeno (HBr) gaseoso en g/L a 788 mm Hg y 45°C.
|