Estequiometría con gases
Son las relaciones estequiométricas cuando reaccionan gases.
EJEMPLO
1.- Calcular el volumen de O2 (en litros) a TPE que se requieren para completar la combustión de 2.65 L de acetileno (C2H2) a TPE.

Analizando el problema podemos darnos cuenta de que la temperatura y la presión permanecen constantes, por lo cual lo único que puede llegar a cambiar son los moles y el volumen.
Para encontrar los moles, vamos a balancear la ecuación química:

Por lo tanto, este problema podríamos resolverlo con la ley de Avogadro de la siguiente forma:
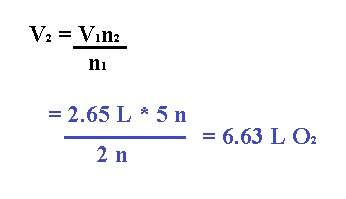
Pero para efectos de este tema, podemos resolver por medio de estequiometría de la siguiente forma:
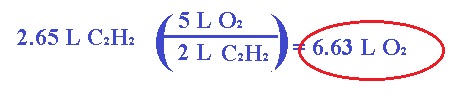
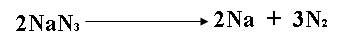
2.- La azida de sodio (NaN3) se usa en bolsas de aire de los automóviles. El impacto de una colisión produce la descomposición de NaN3 como lo muestra la reacción:
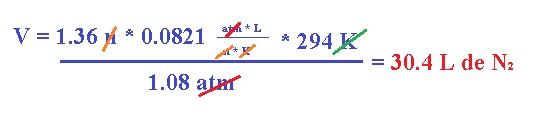
El nitrógeno molecular producido infla la bolsa que se encuentra entre el conductor y el volante. Calcula el volumen de N2 generado a 21°C y 823 mm Hg por la descomposición de 59 g de NaN3.
Primero obtenemos moles de NaN3 en la masa:
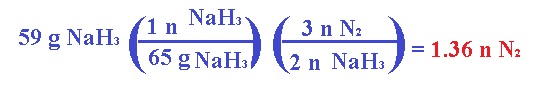
Ahora, procedemos a usar la ecuación de los gases ideales para obtener el volumen como se hace normalmente, convirtiendo primeramente la temperatura a K y la presión a atm:
ACTIVIDAD. Resolver los siguientes problemas.
a) El primer paso en la preparación industrial del acido nítrico (HNO3) es la producción del óxido nítrico (NO) a partir de amoniaco (NH3) y oxígeno (O2).  Si 4.00 L de NH3 a 800 °C y 1.50 atm reaccionan completamente con oxígeno, ¿cuántos litros de vapor mediados a 120 °C y 1.30 atm se forman?
|
b) Un frasco cuyo volumen es de 0.90 L se llena con dióxido de carbono (CO2) gaseoso a la presión de 1.45 atm y la temperatura de 315 K. Una solución de hidróxido de litio (LiOH) de volumen despeciable se introduce en el frasco. Eventualmente, la presión del CO2 se reduce a 0.55 atm porque algo de CO2 se consume en la reacción:  ¿Cuántos gramos de carbonato de litio se forman mediante este proceso? Considera que la temperatura es constante.
|