Examen general del curso para practicar
PARTE 1. APRENDIZAJE DEL LENGUAJE DE LA QUÍMICA.
COMPLETA LOS SIGUIENTES ENUNCIADOS CON LOS TECNICISMOS APRENDIDOS EN ESTE CURSO, hazlo en minúscula y acentos pertinentes.
VALOR DE 1 ACIERTO = 1 PUNTO
| 1) | La cantidad de soluto presente en una cantidad dada de disolución es . | |
| 2) | El es la unidad fundamental de un elemento que puede participar en una combinación química. | |
| 3) | La masa de una sustancia dividida entre su volumen se llama . | |
| 4) | Un es una sustancia que por métodos químicos no se puede descomponer en sustancias más sencillas. | |
| 5) | La se refiere a las relaciones de masa entre reactivos y productos en las reacciones químicas. | |
| 6) | A la cantidad de sustancia que contiene tantas entidades elementales (átomos, moléculas u otras partículas) cuantos átomos hay en 12 gramos del carbono 12 se conoce como | |
| 7) | La es la ciencia que estudia las propiedades de las sustancias y cómo reaccionan éstas entre sí. | |
| 8) | Los son las sustancias de las que se parte en una reacción química. | |
| 9) | Combinación de dos o más sustancias en las que éstas conservan su identidad son llamadas | |
| 10) | Partícula subatómica que tiene una masa muy pequeña y lleva una carga eléctrica unitaria negativa es conocida como . | |
Corregir
Ver Solución
Limpiar | ||
ANOTA EL NÚMERO DE ACIERTOS OBTENIDOS EN TU CUADERNO Y CONTINÚA CON LA SIGUIENTE PARTE DEL EXAMEN.
PARTE 2. APRENDIZAJE DE LA TEORÍA DEL CURSO.
ELIGE LA RESPUESTA QUE CONSIDERES CORRECTA.
VALOR DE 1 ACIERTO = 1 PUNTO
| ||
Corregir
Ver Solución
Limpiar | ||
ANOTA EL NÚMERO DE ACIERTOS OBTENIDOS EN TU CUADERNO Y CONTINÚA CON LA SIGUIENTE PARTE DEL EXAMEN.
PARTE 3. APRENDIZAJE DE LAS HABILIDADES PARA EL TRABAJO DE LA QUÍMICA.
ESCRIBE EL RESULTADO CORRECTO DE LOS SIGUIENTES EJERCICIOS. Únicamente escribe números, si hay decimales REDONDEA a uno. Si el segundo decimal es 5 o menor a 5, deja igual el primer decimal sin cambiar nada; si es mayor de 5, sube una sufra al primer decimal, por ejemplo 1.76= 1.8. Utiliza el punto, no la coma.
VALOR DE 1 ACIERTO = 6 PUNTOS.
| 1) | La velocidad del sonido en el aire a temperatura ambiente es de unos 350 m/s. Calcule esta velocidad en millas por hora.(1 milla = 1609 m; 1 h = 3600 s) mi/h | |
| 2) | Suponga que se ha establecido una nueva escala de temperatura, en la cual el punto de fusión (-117.3°C) y el punto de ebullición del etanol (78.3°C) corresponden a 0°S y 100°S, respectivamente donde S es el símbolo de la nueva escala de temperatura. Desarrollo una ecuación que relacione la lectura de esta escala con la lectura de la escala Celsius. ¿Cuál sería la lectura de este termómetro a 28°C? °S | |
| 3) | El estaño existe en la corteza terrestre como SnO2. Calcule la composición porcentual en masa de Sn. (Masa del Sn: 118.69 g; O: 16 g) % | |
| 4) | El análisis de un cloruro metálico XCl3 revela que contiene 67.2% de Cl en masa. Calcule la masa atómica de X. (Masa del Cl: 35.45 g) g. | |
| 5) | Considera la siguiente reacción: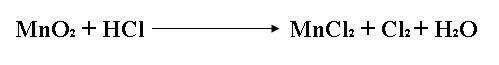 | |
| 6) | Si reaccionan 0.86 moles de MnO2 y 48.2 g de HCl. ¿Cuántos gramos de Cl2 se producirán? g de Cl2 | |
| 7) | El óxido de titanio (IV) (TiO2) es una sustancia que se produce por la adición de ácido sulfúrico sobre el mineral ilmenita (FeTiO3):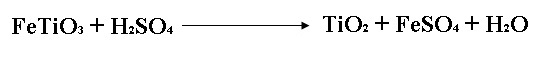 | |
| 8) | Sus propiedades de opacidad e inocuidad lo hacen una sustancia idónea para pigmentos de plástico y pinturas. En un proceso 8.00X103 kg de FeTiO3 produjeron 3.67X103 kg de TiO2. ¿Cuál es el rendimiento porcentual de la reacción? % | |
| 9) | Una aplicación útil del ácido oxálico (H2C2O4) es la eliminación de herrumbre (Fe2O3) de acuerdo con la reacción: | |
| 10) | Calcule la cantidad de herrumbre, en gramos, que se puede remover mediante 5.00X102 mL de solución de ácido oxálico 0.100 M. g de herrumbre. | |
| 11) | Una cantidad de 36.4 L de metano gaseoso se calienta desde 25°C hasta 88°C. ¿Cuál es su volumen final? L | |
| 12) | Un volumen de 0.280 L de un gas a TPE pesa 0.400 g. Calcule la masa molar del gas. g/mol. | |
| 13) | La ecuación para la degradación metabólica de la glucosa es la misma que la de la combustión de la glucosa en el aire: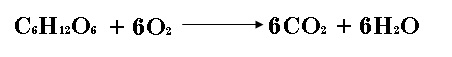 | |
| 14) | Calcule el volumen de bióxido de carbono producido a 37.0°C y 1 atm cuando se utilizan 5.60 g de glucosa en la reacción anterior. L | |
Corregir
Ver Solución
Limpiar | ||
EL NÚMERO DE ACIERTOS MULTIPLICARLO POR 6 Y ANOTA EL RESULTADO.
Calificación: Suma los resultados de las tres partes de este examen y esa es tu calificación final. Se considera APROBADO si obtuviste una calificación MAYOR a 60.

SI HAS LLEGADO HASTA AQUÍ, SIGNIFICA QUE CUENTAS CON GRAN DEDICACIÓN Y, SOBRETODO, DISCIPLINA, ELEMENTAL PARA EL ESTUDIO DE UNA CIENCIA TAN APASIONANTE COMO LO ES LA QUÍMICA.
¡TE FELICITO!
CON EL SIMPLE HECHO DE ESTAR AQUÍ YA ERES UN GANADOR. LO LOGRASTE, YA QUE DECIR "ESTUDIO QUÍMICA" SON PALABRAS MAYORES, PERO QUE LLENAN DE MUCHA SATISFACCIÓN.