Pilas de combustible
Las pilas de combustible son equipos electroquímicos que, al igual que las baterías, convierten directamente en corriente eléctrica la energía química de un reactivo. Sin embargo ambos sistemas son diferentes, mientras que las baterías son acumuladores de energía que sólo pueden trabajar mientras ésta se encuentre almacenada en su interior (por lo que deben haber sido cargadas previamente), estas pilas de combustible son capaces de proporcionar electricidad mientras les sea suministrado un comburente (normalmente hidrógeno) desde una fuente exterior.
El mecanismo fundamental de operación de una pila de combustible es la reacción inversa a la hidrólisis: la oxidación catalítica del hidrógeno en el ánodo y la reducción del oxígeno en el cátodo crean una diferencia de potencial entre ambos electrodos, diferencia que puede ser aprovechada a través de un circuito externo si se coloca un electrolito aislante entre el ánodo y el cátodo que permita el intercambio iónico, y por tanto la transferencia de cargas.
Más detalladamente, una pila de combustible se compone de varias celdas individuales conectadas eléctricamente en serie entre sí, en ellas es donde se genera el flujo de electrones, y su número dependerá de la tensión total que se desea proporcionar. Todas las celdas están provistas de dos placas bipolares, una en cada extremo, por donde penetran los gases reactantes (hidrógeno y oxígeno) y por donde además se evacuan los productos de la reacción y los reactantes no utilizados.
Desde cada placa y hacia el interior se sitúan el ánodo y el cátodo, cada uno de ellos provisto de una capa con un elemento catalizador donde los átomos de hidrógeno se descompondrán en sus protones y electrones, y que además proporciona la conectividad eléctrica entre celdas. Por último, entre los electrodos se encuentra una membrana semipermeable, que actúa de medio conductor de iones. A la agrupación de todas las celdas con el objeto de proporcionar una tensión eléctrica suficientemente alta (según los requerimientos de cada aplicación), se le conoce el nombre de apilamiento o ‘stack’.
Los procesos que tienen lugar en los electrodos permiten obtener rendimientos considerablemente altos que no sólo afectan a la reacción eléctrica, sino que además, y dependiendo del tipo de pila, hacen posible aumentar el rendimiento global de la reacción mediante el aprovechamiento del calor generado durante su funcionamiento normal a causa de la polarización y a las pérdidas óhmicas (también llamadas lineales o resistivas) que tienen lugar en el interior de la pila.
La elección de la pila idónea para cada aplicación dependerá tanto de las posibilidades de aumentar el rendimiento global aprovechando esa energía térmica residual como de la temperatura de trabajo. Esta última puede variar desde las condiciones ambientales hasta los 1000º C, debido a que las reacciones electroquímicas de los electrodos pueden ser catalizadas por diversos materiales a diferentes temperaturas.
Las pilas de combustible se dividen en cinco tipos diferentes, atendiendo al tipo de electrolito que emplean:
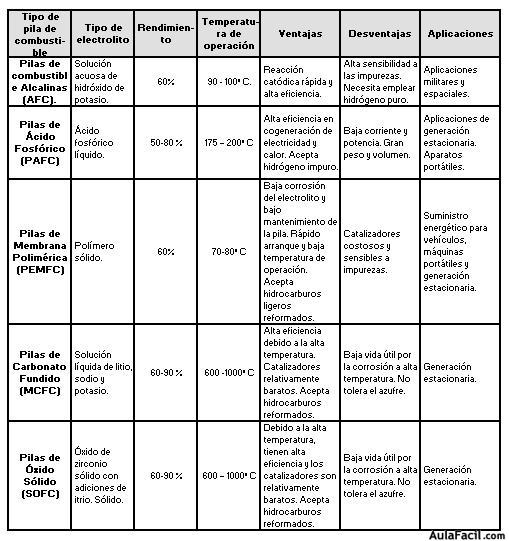
Cabe resaltar que la reacción global, sumando los efectos en el ánodo y cátodo, es la misma para todos los tipos de pila:
H2 + ½ O2 = H2O
Pero, aunque fundamentalmente todas las pilas emplean como reactantes el hidrógeno y el oxígeno, las reacciones que tienen lugar en los electrodos son diferentes en cada caso, según el tipo de pila:
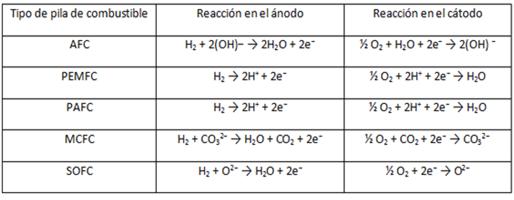
Una de las principales ventajas de las pilas de combustible es que pueden alimentarse con mezclas que tan sólo tengan una pureza del 20-30%, por lo que a efectos prácticos puede emplearse casi cualquier mezcla gaseosa que contenga hidrógeno. En algunos casos se emplean hidrocarburos, aunque el proceso previo de obtención cause pérdidas de eficiencia. La técnica más frecuente para esta operación es el reformado con vapor, aunque existen otras como la oxidación parcial y el reformado autotérmico, en cualquier caso se necesitará de un equipo de tratamiento del combustible y otros equipos auxiliares para el acondicionamiento de la mezcla resultante (procesos de purificación, eliminación de impurezas de CO, desulfuración…) ya que ciertas partículas inicialmente presentes pueden reducir drásticamente la vida útil de la pila.
Los resultados del funcionamiento de una pila de combustible son: una corriente eléctrica continua, agua como producto final de la reacción, y otros subproductos dependiendo del nivel de pureza de los reactivos. Debido a la necesaria limpieza de los gases reactantes y al hecho de que las reacciones electroquímicas son considerablemente limpias, las plantas basadas en pilas de combustible registran niveles de emisiones bajos en comparación con los sistemas tradicionales.
Es posible aumentar el rendimiento de las pilas incrementando las presiones de entrada de oxidante y reductor, sin embargo esto lleva asociada la necesidad de incluir en el sistema los correspondientes equipos de presurización, lo que supone contar con un peso y un volumen adicionales, y una demanda parásita de energía, lo que hace subir el coste global, pero además, a presiones superiores a 5 atmósferas comienzan a dañarse los electrolitos sólidos.
Por último, si se está pensando en el uso de las pilas de combustible como acumuladores de energía en automoción o aparatos portátiles, se deberán tener en cuenta además una serie de requisitos relativos al peso y al volumen ocupado. Si la pila de combustible de un turismo alimentado con hidrógeno me ocupa todo su maletero, se está garantizando el fracaso del modelo a nivel comercial (en referencia a las escasas ventas previsibles).


