Cambios de Estado
A los cuerpos los podemos hallar en la Naturaleza en los estados:
Sólido, Líquido o Gaseoso siendo el calor o la ausencia del mismo (el frío) quienes se encargan de variarlo.
(Existe un cuarto estado llamado Estado de Plasma del que nos ocuparemos más adelante).
En la figura que tienes a continuación vemos en un sencillo esquema los nombres que aplicamos a cada cambio de estado:
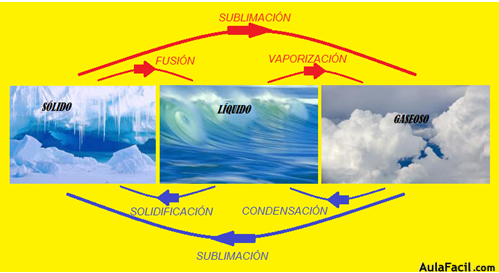
Color rojo – por efecto del calor:
Sólido a Líquido: fusión
Líquido a Gaseoso: vaporización
Sólido a Gaseoso (sin pasar por líquido): sublimación
Color azul – por efecto de la ausencia de calor:
Gaseoso a Líquido: condensación
Líquido a Sólido: solidificación
Gas a Sólido (sin pasar por líquido): sublimación
Cambio de estado progresivos y regresivos
Llamamos cambios de estado progresivos a los que se producen por absorción de calor: fusión, vaporización y sublimación progresiva.
Llamamos regresivos a los cambios de estado producidos cuando pierden calor: condensación, solidificación y sublimación regresiva.
Calor latente de fusión
Cuando una sustancia en estado sólido absorbe calor, su temperatura aumenta, pero sucede que hay un momento en el que la temperatura permanece igual hasta que todo el cuerpo se haya fundido, a pesar de estar cediéndole calor.
Cuando todo el sólido ha pasado a líquido vuelve a aumentar su temperatura al darle calor.
Si tomas un trozo de hielo a 5º bajo cero y le proporcionas calor notarás que la temperatura pasará a -4º, luego a -3º y así hasta 0º.
Verás que continuando con la cesión de calor cuando se encuentra a 0º, su temperatura no sigue subiendo hasta el momento en el que todo el hielo ha pasado al estado líquido y ahora su temperatura volverá a subir.
Llamamos calor latente de fusión a la cantidad de calor necesaria para que TODA la masa de una sustancia se haya fundido.
Sucede también que si tienes agua en estado líquido y le aplicas calor llega un momento en el que comienza a evaporarse y No aumenta su temperatura hasta que todo el líquido no haya pasado al estado gaseoso.
El agua a la altura del mar comienza a hervir a los 100º pero hay un período de tiempo en el que la temperatura no sube a pesar de aplicarle calor hasta que todo el líquido no haya pasado al estado gaseoso.
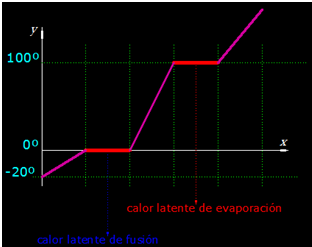
En la última figura puedes ver un gráfico en el que la temperatura va subiendo hasta que al llegar a 0º se mantiene estable durante un período de tiempo y después vuelve a subir (calor latente de fusión) hasta que al llegar a 100º se mantiene inalterable durante un tiempo con la misma temperatura hasta que todo el líquido no se haya transformado en vapor (calor latente de evaporación).
¿Por qué llamamos Latente?
La palabra latente procede del latín latens que significa escondido, oculto.
En las fases de fusión y evaporación el calor está oculto o escondido un tiempo no lo podemos medir.

4.1 Dos líneas más arriba hemos utilizado la palabra fase y no estado (fase de fusión, fase de evaporación – estado de fusión, estado de vapor). ¿Por qué crees que hacemos esta diferencia?
Razona tu respuesta.
Respuesta – Solución: Suponiendo que nos referimos al hielo. Cuando llega a 0º comienza a derretirse y se mantiene en esta fase hasta que todo el hielo no se haya convertido en líquido. A partir del momento en que TODO el hielo se ha convertido en agua nos referimos al estado líquido.
El razonamiento para la fase de evaporación y estado gaseoso es el mismo.
4.2 Probablemente hayas visto tirar sal sobre la nieve en las aceras, carreteras, etc. ¿Por qué?

¿Cómo razonas la respuesta?
Respuesta – Solución:
En primer lugar, la sal no derrite el hielo. El hielo se derrite o se funde con el calor.
¿Qué hace la sal? La sal disuelve el hielo, la nieve. El modo de hacerlo se estudia bajo el punto de vista químico debido al comportamiento de los iones del sodio y del cloro (componentes de la sal) frente al agua o cristales de agua.
Bajo el punto de vista de la Física a nosotros nos interesa saber que cuando el hielo o la nieve se funden por causa de la sal, se forma agua salada.
El agua salada necesita menor temperatura para congelarse que el agua dulce. Depende de la cantidad de sal que contenga.
Para que tengas una idea (los datos son aproximados), con una concentración de sal del 6% se necesita que la temperatura sea de casi -6ºC y si la cantidad de sal disuelta representa un 20% harían falta casi -20ºC para que se congele.
Como ves, interesa que el hielo o la nieve se transformen en agua salada y el suelo no estará helado porque hará falta mucho más frío del que hace para que se transforme en hielo.
4.3 En las fotografías que tienes debajo puedes comprobar terrenos salinos en los que la actividad agrícola es casi nula.

¿Por qué en algunas ciudades donde los inviernos son muy crudos se prohíbe echar sal en las carreteras, aceras, etc.?
Respuesta – Solución
El agua salada a través del alcantarillado pasa a los ríos. Los ríos alimentan cultivos, acuíferos, etc. La fauna de los ríos no soporta el grado de sal de su medio ambiente y muere. A las plantas les sucede lo mismo.
Sencilla Representación Gráfica aproximada de las móleculas según el estado de la materia.
Observemos la siguiente figura:
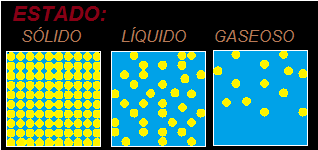
En el estado sólido las moléculas se hallan muy unidas unas a otras de modo que su forma y volumen permanecen estables y no tienen fluidez.
Al estar tan unidas sus moléculas nos es casi imposible poderlas comprimir.
En el estado líquido las moléculas apenas se atraen unas a otras. Se deslizan unas sobre otras. Esta propiedad permite a los líquidos adaptarse a los recipientes que los contienen.
Con el mismo Volumen adoptan formas diferentes de acuerdo con el envase donde se hallan.
En el estado gaseoso sus moléculas se hallan muy dispersas por lo que podemos comprimirlas fácilmente variando su forma y su Volumen.
Las Moléculas y el Calor
Volvemos a repetir esta idea.
En el caso del estado sólido el calor hace que vibren las moléculas lo que produce un pequeño distanciamiento entre ellas y se nota un aumento del volumen aunque su masa permanece igual.
A medida que aumenta la temperatura también aumenta la vibración.
En el caso del estado líquido el calor hace que el movimiento de sus moléculas se incremente de un modo notable. Se llega a que las que se hallan en la superficie “se escapen”, salgan al aire.
En el estado gaseoso al recibir energía en forma de calor hace que las moléculas se muevan a mayor velocidad y con total libertad produciendo choques contra el recipiente y entre ellas. Estos choques producen un fenómeno que lo conocemos con el nombre de presión. A mayor velocidad, mayor el número de choques y mayor presión.

