Reacciones simultáneas.
Cuando suceden cambios químicos (reacciones químicas), muchas veces ocurren varias de ellas de manera simultánea. Al ocurrir esto se puede decir que tienen lugar reacciones múltiples.
En este tema vamos a analizar un caso particular de reacciones simultáneas que para poder resolver vamos a necesitar la utilización de un sistema de ecuaciones lineales, estudiados en las primeras lecciones.
EJEMPLO
1.- Se descompone por calentamiento una mezcla de 4.00 g de clorato de potasio (KClO3) y perclorato de potasio (KClO4), produciéndose 2.40 g de cloruro de potasio (KCl). Además de este producto, se obtiene oxígeno molecular en las dos reacciones simultáneas de descomposición. Calcula el tanto por ciento de cada sal en la mezcla inicial.
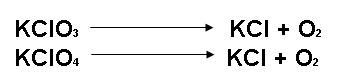
Lo primero que vamos a hacer es balancear las ecuaciones:
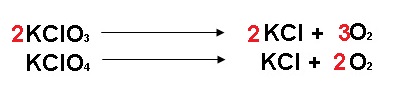
Tenemos que entender que nos piden encontrar el porcentaje o, para ser más específicos, la concentración en masa (%) de cada componente de la MEZCLA conformada por clorato y perclorato de potasio. Dicha mezcla pesa 4 g, y al efectuarse las reacciones producen 2.40 g de cloruro de potasio.
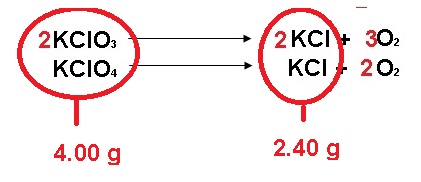
Ahora, para proceder a sacar el porcentaje necesitamos conocer cuántos gramos hay de cada componente de la mezcla. A partir de aquí vamos a establecer un sistema de ecuaciones. Podemos decir que:
x= KClO3
y= KClO4
por lo tanto, x + y = 4; despejada: y= 4-x
La segunda ecuación del sistema la vamos a sacar de la cantidad de cloruro de potasio, ya que es el otro dato que nos dan; recordamos que para sacar la cantidad de producto hacemos el siguiente proceso, solo que esta vez será con variables, para así formular otra ecuación, para lo cual, además, vamos a sacar las masas teóricas:
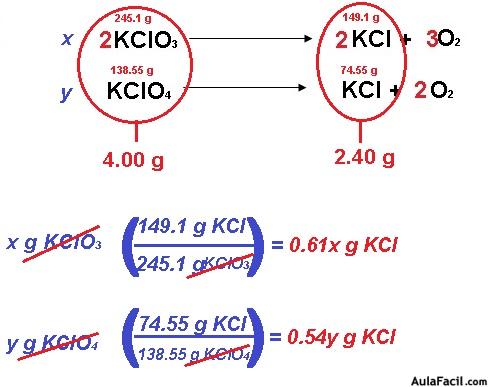
Por lo tanto, la segunda ecuación queda como: 0.61x +0.54y = 2.40
Procedemos a resolver como aprendimos en las primeras lecciones por medio del método de sustitución:
0.61x + 0.54 (4-x) = 2.40
0.61x + 2.16 – 0.54x = 2.40
0.61x -0.54 = 2.40 -2.16
0.07x = 0.24
x= 3.43 g KCl3
Con el valor obtenido, sustituimos en la primera ecuación:
y= 4 – 3.43 = 0.57 g KClO4
Ya tenemos las masas, ahora vamos a sacar el porcentaje de concentración que se obtiene de la misma forma que la composición porcentual de compuestos, es decir, dividiendo la masa del compuesto entre la masa total de la mezcla y multiplicar por 100:
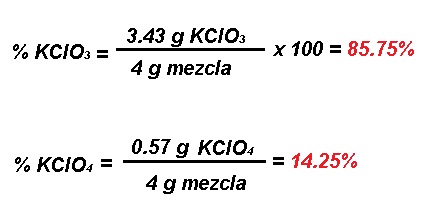
ACTIVIDAD: Resuelve el siguiente ejercicio.
a) Una muestra de 0.156 g de aluminio y zinc se trata con exceso de ácido sulfúrico, desprendiéndose en las dos reacciones un total de 0.114 L de hidrógeno a 27 °C y 725 mm. En el primer caso se obtiene además sulfato de aluminio y en el segundo sulfato de zinc. Calcula el porcentaje de cada elemento en la muestra (Al y Zn). 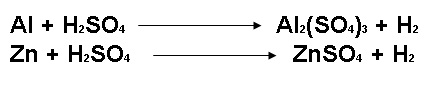
|