Balanceo de ecuaciones químicas
En todo momento estamos rodeados de cambios químicos. Algunos logramos observarlos a simple vista, como cuando cocinas un huevo y se naturalizan las proteínas, otros no podemos observarlos fácilmente, como la fotosíntesis que realizan las plantas. Esos cambios químicos se conocen como reacciones químicas.
Una reacción química es un cambio permanente de la materia, de manera que de ciertas sustancias se obtienen otras completamente diferentes. Las sustancias iniciales son llamadas reactivos. Estos, en presencia de algún catalizador o sin él, se transforman en las sustancias finales diferentes llamadas productos.
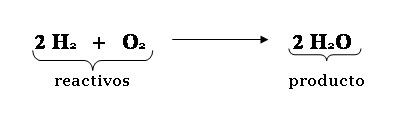
Como cualquier ciencia, la química también necesita de modelos matemáticos para su representación analítica de la realidad, de los fenómenos químicos. Para ello, se utiliza lo que se conoce como ecuación química, es decir, una representación de la reacción química mediante símbolos de los elementos, más otros como…

EJEMPLO
1.- Escribe una reacción química para lo siguiente: El óxido nítrico reacciona con oxígeno molecular para formar dióxido de nitrógeno.
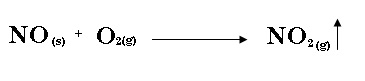
Dos tipos de reacciones muy comunes en la industria así como en el estudio de la química son:
a) Reacciones de combustión. Es aquella que se da cuando algo se quema o existe fuego, es decir, mediante la combinación de un combustible (generalmente es una fuente de carbono) más oxígeno molecular, en presencia de calor nos produce bióxido de carbono más agua siempre.

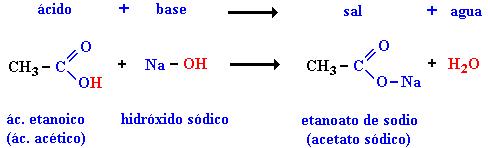
b) Reacción de neutralización. Es aquella que tiene como reactivos a un ácido más una base o álcali, y al momento del contacto reaccionan produciendo siempre una sal más agua. La sal producida va a depender del ácido y la base de los cuales procede.
EJERCICIO DE REFLEXIÓN RÁPIDO:
Observa y analiza a detalle la reacción del ejemplo anterior:
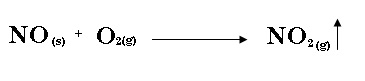
¿Cuántos átomos de nitrógeno y de oxígeno hay en los reactivos?
N ________________ O__________________
¿Cuántos átomos de nitrógeno y de oxígeno hay en los productos?
N ________________ O__________________
Ahora, vamos a recordar que Antoine-Laurent de Lavoisier, con quien nace la química como ciencia, formuló la “Ley de la conservación de la materia” que dice: “La materia no se crea ni se destruye, sólo se transforma”. Partiendo de dicha ley, ¿qué crees que suceda en esta reacción? Escribe tus ideas.
|
¿Por qué crees que hay un oxígeno de menos si la ley dice que “la materia no se destruye”, a dónde se fue ese átomo?
|
¿Cómo piensas que se soluciona esta situación?
|
Ahora bien, vamos a conocer lo que se conoce como balanceo de ecuaciones químicas por el método del tanteo, algo necesario para que siempre se cumpla la Ley de la conservación de la materia de Lavoisier.
Una reacción química se puede considerar balanceada cuando tanto en los reactivos como en los productos existe la misma cantidad de átomos, no de moles. Para lograr esto, podemos agregar únicamente coeficientes (los cuales indican moles), pero NUNCA modificar los subíndices, ya que si hacemos esto estaríamos cambiando los reactivos o productos por otros diferentes.
EJEMPLO
1.- Balancea la siguiente ecuación química.

ACTIVIDAD. Resuelve lo siguiente:
a) Balancea las siguientes ecuaciones químicas por el método de tanteo.
CuFeS2 + O2 <--> SO2 + CuO + FeO
|
Na2CO3 + H2O + CO2 <--> NaHCO3
|
NaNO3 + KCl <--> NaCl + KNO3
|
HCl + MnO2 <--> MnCl2 + H20 + Cl2
|
H2SO4 + NaCl <--> Na2SO4 + HCl
|
H2O + Na <--> Na(OH) + H2
|
b) El oro no puede disolverse en ácido nítrico concentrado ni en ácido clorhídrico concentrado; sin embargo, el metal se disuelve en una mezcla de los dos ácidos (una parte del nítrico y tres partes del clorhídrico en volumen), llamada agua regia. Escriba una ecuación balanceada para esta reacción (Nota: entre los productos de esta reacción se encuentra el HAuCl4 y el NO2).
|