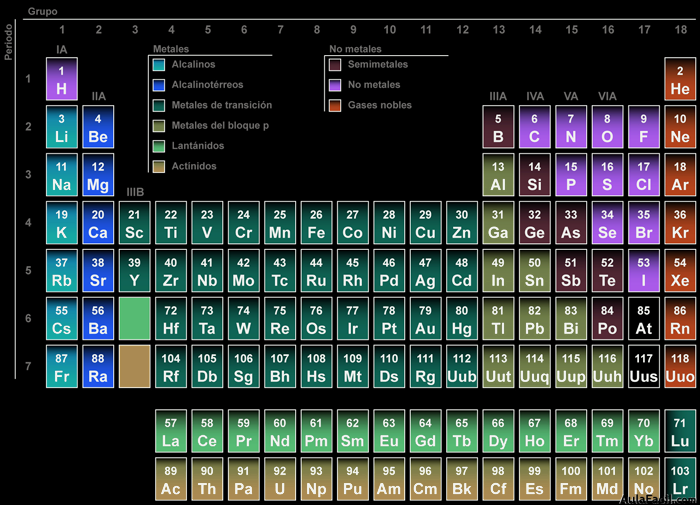
La tabla periódica
1. Los elementos
Un elemento es una sustancia pura que ya no se puede separar más en otras más simples por métodos (reacciones) químicos.
Cada elemento químico está constituido por átomos con las mismas propiedades químicas.
Los elementos químicos se identifican mediante nombres dados en la antigüedad, derivados de alguna propiedad de los mismos.
En la naturaleza existen 92 elementos.
2. Metales y no metales
Los elementos según sus propiedades los podemos clasificar en dos grupos generales:
2.1 Metales:
- Son sólidos a temperatura ambiente (excepto el mercurio).
- Reflejan la luz de una forma característica (brillo metálico).
- Son dúctiles, ya que se pueden estirar en hilos.
- Son maleables, ya que con ellos se puede hacer planchas o láminas fácilmente.
2.2 No Metales:
- No tienen brillo metálico.
- Pueden ser sólidos, líquidos o gases a temperatura ambiente.
- No conducen la electricidad.
- En general son frágiles.
3. Clasificación de los elementos, la tabla periódica
La colocación de los elementos en la tabla periódica se hace teniendo en cuenta la configuración electrónica de forma que aquellos con propiedades químicas semejantes se encuentren situados cerca uno de otros.
3.1 La tabla de Mendeleiev
Esta tabla consiste, en síntesis, en disponer los elementos químicos en un cuadro en orden creciente de sus masas atómicas, notándose una analogía en sus propiedades cada cierto número de elementos (por eso se denomina tabla periódica).
Mendeleiev demostró que los elementos con propiedades químicas semejantes aparecían periódicamente, dando lugar a ocho grupos. En algunos lugares faltaba un elemento, pero Mendeleiev no dudó en predecir su existencia y su comportamiento químico, lo que posteriormente se confirmó.
3.2 La tabla periódica actual
Aunque está basada en la propuesta por D. Mendeleiev en 1869, el criterio de ordenación (debido entre otros a los estudios de Henry Moseley) es otro. En ella, los elementos se encuentran ordenados de izquierda a derecha, por valores crecientes de sus números atómicos (Z). Además de esto, los elementos aparecen distribuidos en filas y columnas.
Existen 7 filas horizontales que se denominan períodos y 18 columnas verticales que se denominan grupos.
El número del periodo nos da el número total de capas u órbitas que tienen los átomos de los elementos.
El número del grupo nos da el número de electrones que tienen los átomos en su última capa.
Los elementos también se clasifican en: metales, no metales, semimetales y gases nobles, de acuerdo con sus propiedades para ganar o perder electrones.
4. Elementos químicos más representativos
4.1 Los gases nobles
El helio, el neón, el argón y kriptón son los primeros elementos de esta familia. Sus moléculas son monoatómicas, es decir, están constituidas por un único átomo.
No reaccionan con los otros elementos, por eso se les denomina también gases inertes.
- El helio. Tiene el menor punto de ebullición de todos los elementos. En la atmósfera se encuentra en pequeñas cantidades. Se emplea en el llenado de globos y dirigibles.
- El neón. Es usado en carteles luminosos debido a su luz rosa.
- El argón. Es incoloro inodoro e insípido. En condiciones normales es un gas, pero puede licuarse y solidificarse. Se usa en lámparas eléctricas y tubos fluorescentes.
- El kriptón. Se usa en solitario o mezclado con neón y argón en lámparas fluorescentes; en sistemas de iluminación de aeropuertos, ya que el alcance de su luz roja es mayor que la ordinaria.
4.2 El Hidrógeno
Es el elemento más abundante del universo. Constituye la parte principal de la estrellas y del sol, donde se produce la llamada fusión nuclear que es la responsable de la energía emitida por las estrellas.
En la Tierra es el tercer elemento en importancia y se encuentra combinado con otros elementos como el oxígeno (formando el agua) y el carbono (como hidrocarburos). En estado libre se encuentra en baja proporción en la atmósfera y en forma de molécula diatómica.
4.3 Los alcalinos
Esta familia incluye los elementos litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr).
Son todos metales sólidos a temperatura ambiente, blandos y forman iones con una carga positiva.
Reaccionan fácilmente con los otros elementos, por eso no se encuentran libres en la naturaleza.
Se oxidan cuando son expuestos al aire y reaccionan violentamente con el agua para formar el correspondiente hidróxido e hidrógeno gaseoso.
4.4 Los alcalinotérreos
A este grupo pertenecen los elementos berilio (Be), magnesio (Mg), calcio (Ca) y bario (Ba). Son todos metales (como los alcalinos) y forman iones con dos cargas positivas.
Se oxidan fácilmente en contacto con el aire y reaccionan con el agua para formar el correspondiente hidróxido e hidrógeno gaseoso.
4.5 Los metales de transición
A estos periodos pertenecen los elementos cromo (Cr), manganeso (Mn), hierro (Fe), cobalto (Co), níquel (Ni), cobre (Cu), cinc (Zn), plata (Ag), cadmio (Cd), platino (Pt), oro (Au), mercurio (Hg), wolframio (o tungsteno) (W), titanio (Ti)...
Excepto el mercurio, todos son sólidos a temperatura ambiente.
En la naturaleza se encuentran combinados con otros elementos, aunque el oro, el cobre y la plata se pueden encontrar libres.
Conducen la corriente eléctrica y el calor fácilmente. Forman iones positivos.
4.6 Los térreos
A este grupo pertenecen los elementos boro (B), aluminio (Al), indio (In) y talio (Tl).
Constituyen más del 7% en peso de la corteza terrestre, sobre todo el aluminio (metal más abundante y tercer elemento más abundante de la corteza después del oxígeno y del silicio).
El indio y el talio son muy raros.
A temperatura ambiente son sólidos.
Son bastante reactivos, por eso en la naturaleza no se encuentran en estado libre y forman iones con tres cargas positivas.
La mayoría de sus minerales son óxidos e hidróxidos y, en el caso del galio, del indio y del talio, se encuentran asociados con minerales de plomo y de cinc.
4.7 Carbonoideos
A este grupo pertenecen los elementos carbono (C), silicio (Si), estaño (Sn) y plomo (Pb).
Todos son sólidos cuando no están combinados. El carbono se encuentra libre en la naturaleza en dos formas alotrópicas: el diamante y el grafito.
Combinado con otros elementos, forma los llamados hidrocarburos y los compuestos característicos de la vida: azúcares, proteínas, grasas...
El silicio se encuentra normalmente en forma de óxido: el cuarzo y la sílice.
El estaño y el plomo son dos metales y están combinados en la naturaleza.
4.8 Nitrogenoideos
Entre estos elementos se encuentran el nitrógeno (N), el fósforo (P) y el arsénico (As).
- El nitrógeno se encuentra en estado libre (N) constituyendo el 78% de las moléculas de la atmósfera y combinado con otros elementos formando muchos compuestos (como nitratos y nitritos). Cuando se encuentra en estado libre es muy poco reactivo.
- El fósforo es un sólido que se presenta principalmente en dos formas alotrópicas: fósforo rojo y fósforo blanco, normalmente se encuentra combinado formado las sales denominadas fosfatos. Tanto el nitrógeno como el fósforo o el arsénico forman iones con tres cargas negativas.
- El arsénico fue usado durante mucho tiempo como veneno para controlar plagas. Hoy en día se utiliza en la fabricación de semiconductores en combinación con el silicio y el galio.
- El antimonio se usa en la industria de semiconductores y para aumentar la dureza en algunas aleaciones.
4.9 Anfígenos o calcógenos
El oxígeno (O) y el azufre (S) son los elementos más importantes de este grupo.
- El oxígeno se encuentra en la naturaleza en estado libre (O), constituyendo el 20% de las moléculas de la atmósfera y combinado como óxidos, ácidos o sales.
- El azufre es un sólido amarillo que se puede encontrar libre o combinado formando sulfatos, sulfitos y sulfuros.
- El selenio es un sólido gris. Puede convertir la luz en electricidad (efecto fotoeléctrico). Se usa en xerografía y fotografía para potenciar los tonos.
- El telurio se obtiene del mineral calaverita combinado con el oro.
4.10 Halógenos
El flúor, el cloro, bromo y yodo forman parte de este grupo.
En la naturaleza están siempre combinados. En estado libre sus moléculas tienen dos átomos.
El elemento flúor es un gas de color amarillo, mientras que el cloro es de color verde, el bromo pardo rojizo y el yodo marrón con brillo.