Introducción química orgánica
1. Introducción
La vida natural como la conocemos hoy se basa en compuestos del carbono. Largas cadenas de átomos de carbono unidos a otros elementos forman las moléculas que intervienen en los procesos vitales.
La química orgánica, también llamada química del carbono, se ocupa de estudiar las propiedades y reactividad de todos los compuestos que llevan carbono en su composición.
El número de compuestos orgánicos existentes, tanto naturales (proteínas, grasas, azúcares...) como artificiales (plásticos) es prácticamente infinito, dado que el átomo de carbono tiene gran capacidad para:
- Formar hasta cuatro enlaces de tipo covalente. Estos enlaces pueden ser sencillos, dobles o triples.
- Enlazarse con elementos tan variados como hidrógeno, oxígeno, nitrógeno, azufre, flúor, cloro, bromo, yodo...
- Constituir cadenas de variada longitud, desde un átomo de carbono hasta miles; lineales, ramificadas o incluso, cíclicas.
2. Características del átomo de carbono
El carbono es un elemento cuya mayoría de átomos tienen seis neutrones en su núcleo y seis electrones girando a su alrededor.
Los electrones del átomo de carbono se disponen en dos capas: dos electrones en la capa más interna y cuatro electrones en la más externa.
Esta configuración electrónica hace que los átomos de carbono tengan múltiples posibilidades para unirse a otros átomos (con enlace covalente), de manera que completen dicha capa externa (ocho electrones).
Como los enlaces covalentes son muy fuertes, los compuestos de carbono serán muy estables.
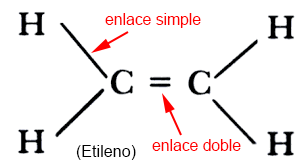
Los átomos de carbono pueden formar enlaces simples, dobles o triples con átomos de carbono o de otros elementos (hidrógeno habitualmente).
Los enlaces dobles y triples son más fuertes que los simples.
Como los átomos de carbono pueden unirse a otros átomos de carbono, se pueden formar largas cadenas.
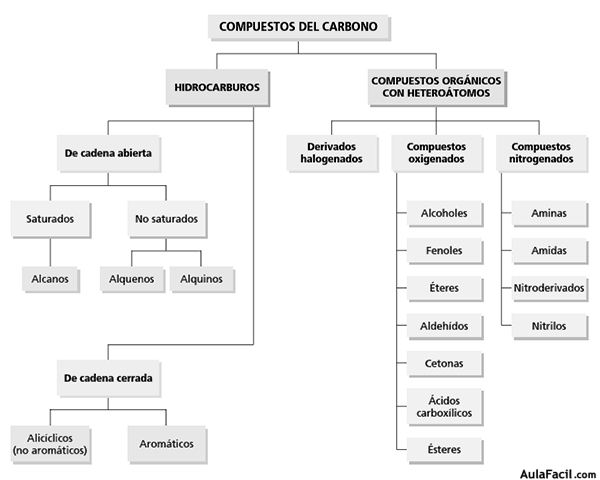
3. Compuestos del carbono
3.1 Los hidrocarburos
Los hidrocarburos son compuestos formados por carbono e hidrógeno solamente.
El más simple es el metano (CH4), pero a medida que añadimos átomos de carbono a la cadena, la complejidad de la molécula crece. En general, la fórmula de un hidrocarburo lineal (con todos los enlaces simples) es la siguiente:
CnH2n+2
Por ejemplo, el hidrocarburo que tiene 5 átomos de carbono tendrá 2·5+2=12 átomos de hidrógeno. Se llama pentano. Su fórmula es C5H12
3.2 Los compuestos oxigenados
El oxígeno es un elemento cuyos átomos tienen ocho protones en su núcleo y ocho electrones dispuestos de la siguiente manera, dos electrones en la capa interna y seis en la capa externa.
De esta forma puede formar enlaces covalentes simples o dobles al compartir uno o dos pares de electrones con otros átomos, en el caso del carbono, puede combinarse formando enlaces simples o dobles.
Los alcoholes, los aldehídos, las cetonas, los ácidos carboxílicos y los ésteres son ejemplos de compuestos de carbono oxigenados.
3.3 Los compuestos nitrogenados
Los átomos de nitrógeno tienen siete protones en su núcleo y siete electrones dispuestos de la siguiente manera: dos electrones en la capa interna y cinco en la capa externa.
De esta forma puede formar enlaces covalentes simples, dobles o triples al compartir uno, dos o tres pares de electrones con otros átomos. Por tanto, puede formar enlaces simples, dobles o triples con los átomos de carbono.
Las aminas, las amidas y los nitrilos son compuestos de carbono nitrogenados.