Niveles electrónicos
Es razonable pensar que si la luz es una onda electromagnética se vea influenciada por partículas son estas características, como protones y electrones. Y precisamente, es así. El origen del color proviene principalmente de transiciones entre niveles electrónicos.
Los electrones (e⁻) son partículas elementales de carga negativa que, en un átomo, rodean a un núcleo positivo (+) (conformado por protones y ocasionalmente neutrones).
Cuando la luz interactúa con un átomo, lo hace con los electrones, ya que estos están más expuestos. Para interactuar con el núcleo se requiere de luz de alta energía, que está fuera del intervalo que estamos estudiando.
Los electrones que rodean el núcleo, se disponen en distintos niveles, niveles energéticos (K, L, M, etc). A su vez se confinan dentro de subniveles (s, p, d, f, g, etc).
En la imagen siguiente se representa un átomo (izquierda) en la que se observa la división de niveles energéticos, y estos a su vez de subniveles.
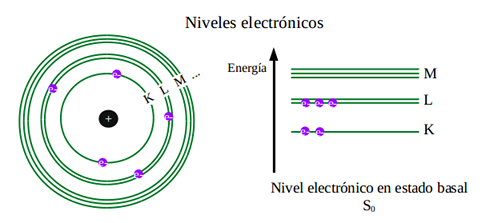
En la imagen se representa a los electrones confinados en órbitas circulares, pero en realidad son estructuras más complejas, denominados orbitales. Para evitar esta confusión se utiliza una representación de los niveles y subniveles en función de su energía. Esta representación se puede apreciar en la figura de la derecha.
El número de electrones y los niveles y subniveles ocupados, determinan una configuración electrónica. Si representamos a la configuración electrónica como un solo estado, determinamos un nivel electrónico. En la figura se representa un nivel electrónico S0, que tiene la configuración electrónica determinada por los niveles y subniveles ocupados.
El 0 en S0 se refiere a que es un estado basal (estado en equilibrio) de multiplicidad singlete (S). La multiplicidad tiene que ver con las distintas configuraciones que pueden dar la misma energía. En este caso hay sólo una configuración que puede dar esta energía, por lo tanto es singlete (S), si hubiera dos configuraciones sería doblete (D), si tuviera tres, triplete (T), etc.
Cuando tratamos con un átomo, los orbitales se denominan orbitales atómicos (OA), para diferenciarlos de los orbitales moleculares (OM):
Cuando dos átomos se acercan, los orbitales atómicos de cada átomo se "fusionan", generando un nuevo orbital, el orbital molecular, dando lugar a la formación del enlace químico.
El número de electrones y los niveles y subniveles ocupados en una molécula, determinan una configuración electrónica molecular. Si la representamos como un solo estado, determinamos un nivel electrónico molecular. Tanto los orbitales moleculares como los niveles electrónicos moleculares se escriben con letras griegas, para diferenciarlos de los atómicos.
Resumiendo: la luz visible (y también la ultravioleta) interacciona con la materia a través de transiciones entre los niveles electrónicos (atómicos o moleculares).