Fotoluminiscencia
2d. Fotoluminiscencia

En la lección Emisión por ionización vimos casos de luminiscencia que pueden ser inducidos por calor, electricidad, etc. En esta lección veremos el caso en que la excitación ocurre por luz.
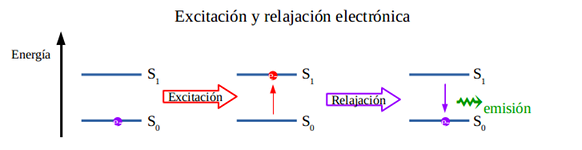
Si incidimos con luz blanca, algunas longitudes de onda serán absorbidas para excitar el electrón. Si representamos el espectro de absorción, será la luz blanca menos la que se absorbió.
A su vez, cuando el electrón se relaja, emite radiación de la misma frecuencia que la absorbida. Si representamos el espectro de emisión será el de la luz emitida, y es el complementario al espectro de absorción.
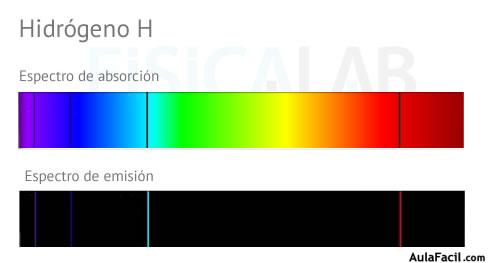
Cuando los electrones vuelven al estado basal, no siempre lo hacen mediante un proceso de emisión directa. Pueden ocurrir procesos radiativos (con emisión de luz) o no radiativos (sin emisión de luz). Para entender estos procesos hay que incluir el concepto de niveles vibracionales, y recordar el concepto de multiplicidad.
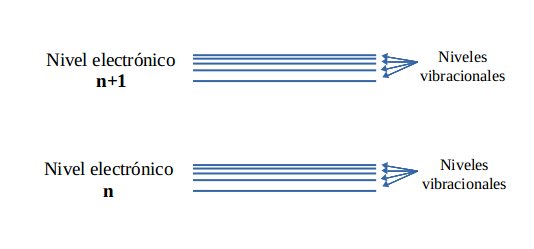
Los niveles vibracionales son de menor energía que los niveles electrónicos y están vinculados a las vibraciones moleculares. Cuando se representa un nivel electrónico hay que tener en cuenta que está subdividido en varios niveles vibracionales:
Otro concepto que hay que recordar es que los niveles electrónicos tienen multiplicidad. La multiplicidad es la capacidad en que pueden existir distintos niveles con la misma energía. Por ejemplo, los orbitales atómicos p tienen multiplicidad 3, ya que pueden existir como px, py y pz, todos estos niveles tienen la misma energía, pero se diferencian en la orientación espacial.
Los procesos por el cual el electrón puede volver al estado basal se representan en la siguiente imagen:
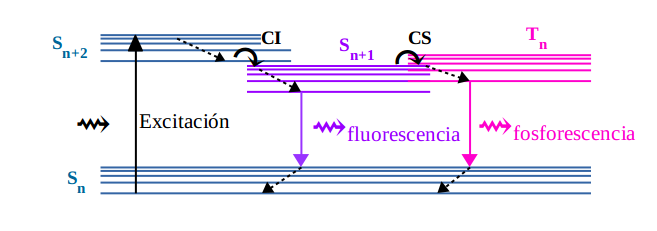
Las flechas de línea entrecortada indican relajación vibracional, son procesos no radiativos. Cuando el electrón pasa otro nivel excitado pero de la misma multiplicidad (como entre dos niveles S), ocurre una conversión interna (CI), si pasa a otro nivel pero de distinta multiplicidad (como de S a T) ocurre un cruce entre sistemas (CS).
Cuando el electrón vuelve al estado basal desde un nivel excitado de la misma multiplicidad, emite luz como fluorescencia. Como el proceso está permitido por las reglas de selectividad, ocurre rápido (<10-8 s).
Cuando el electrón vuelve desde un nivel excitado de distinta multiplicidad, emite luz como fosforescencia. El proceso no está permitido por las reglas de selectividad y por lo tanto ocurre más lentamente (>10-8 s).
Lo particular de estos procesos es que la energía de la emisión fluorescente o fosforescente es menor a la energía de la absorción. O dicho de otra forma, la luz que se genera tiene una longitud de onda mayor. Esto permite a algunos compuestos ser iluminados con luz en la zona del UV y fluorescer o fosforescer en la zona del Visible. Los billetes vienen con figuras dibujadas con tinta fluorescente que no se ven hasta que se ilumina bajo la luz UV.

Algo también interesante es que la emisión por fosforescencia tarde mucho tiempo. Esta es la razón de los objetos que "brillan en la oscuridad". Cuando estos materiales están bajo la luz, se "cargan" (absorben luz y se excitan los electrones), y al retirar la luz empiezan a brillar (por el proceso de fosforescencia) y continúan así durante toda la noche (debido a que la fosforescencia dura mas tiempo).

La siguiente figura es un espectro de absorción (línea azul) de una molécula orgánica, solapada con el espectro de emisión (línea verde) por fluorescencia:
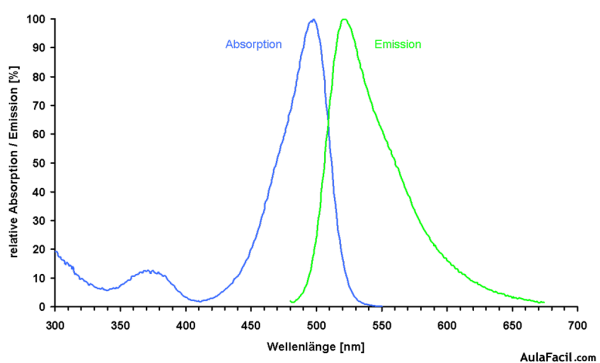
Se puede observar que el espectro de emisión es la imagen especular al de absorción. En este caso, la emisión ocurre por la absorción del pico a 500 nm.
Se puede apreciar también que el pico de emisión aparece a mayor λ, y por lo tanto a menor energía que el pico de absorción.
En los compuestos orgánicos, la fluorescencia y fosforescencia suele ocurrir entre orbitales moleculares π-π* o π-n. Por esto, los compuestos orgánicos que presentan fotoluminiscencia poseen dobles o triples enlaces en alguna parte de la molécula
A veces se refiere como "colores fosforescentes" a colores muy brillantes. Esto no es correcto, ya que el proceso es de reflexión o esparcimiento del color en cuestión.