Los gases y la Teoría Cinética: teoría atómica y gas ideal
1. Los estados de la materia
La materia que nos rodea puede adoptar distintos estados en nuestro modo de percibirlas: color, solidez, textura, etc... pero la forma más general de clasificar el estado de la materia que nos rodea es en tres grandes grupos. sólido, líquido y gas.
2. Teoría atómica de la materia
El físico inglés J. Dalton (1766-1844) establece la Teoría atómica de la materia en la que se considera que todo tipo de materia, sea sólido, líquido o gas, está constituida por partículas, que en principio se llamaron átomos.
Sólido: en un sólido, las "partículas" ocupan posiciones determinadas en una red, alrededor de las cuales vibran cada vez más intensamente a medida que aumentamos la temperatura. Las fuerzas atractivas entre las partículas del sólido son muy intensas.
Líquido: en un líquido, estas "partículas" se mueven deslizándose unas cerca de otras y manteniéndose unidas por débiles fuerzas atractivas entre ellas.
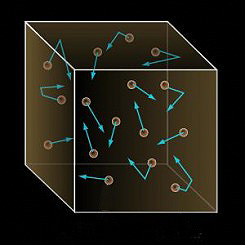
Gas: en el caso de un gas, estas "partículas" se mueven a grandes velocidades y las fuerzas atractivas entre ellas podemos considerarlas como inexistentes. Se mueven al azar ocupando todo el volumen del recipiente.
3. Gas ideal
Un gas ideal es un gas teórico compuesto de un conjunto de partículas puntuales con desplazamiento aleatorio que no interactúan entre sí. El concepto de gas ideal es útil porque comporta una ecuación de estado simplificada, y puede ser analizada mediante la mecánica estadística.
Enunciamos sus características :
1. Las partículas del gas son pequeñísimas comparadas con el volumen del recipiente.
2. Se mueven al azar con distintas velocidades de manera que, si aumenta la temperatura, aumenta la velocidad de las partículas del gas.
3. No existen fuerzas de atracción entre ellas.
4. En su movimiento chocan entre ellas y con las paredes del recipiente, cumpliéndose las leyes de los choques elásticos.
5. Cuando chocan aparecen las fuerzas o interacciones entre ellas o con las paredes del recipiente.
6. Los choques con las paredes del recipiente producen el efecto que llamamos presión sobre las mismas.