Cantidades de reactivos y productos
Ahora vamos a estudiar los aspectos cuantitativos de las reacciones o ecuaciones químicas. La estequiometria representa las relaciones ponderales (es decir, de masa) entre los reactivos y los productos de una reacción, para ello utilizaremos el concepto de mol y masas moleculares.
Con esto, vamos a poder dar respuesta a dos cuestionamientos esenciales:
- Si se conocen las cantidades de las sustancias iniciales (reactivos) en una reacción, ¿qué cantidad de producto se formará?
- ¿Qué cantidad de materia prima se debe usar para obtener una cantidad específica de producto?
El método del mol sirve para conocer o dar respuesta a estas dos cuestiones, y se basa en que los coeficientes de la reacción balanceada se interpretan como los moles de cada sustancia.
IMPORTANTE: En todos los ejercicios que se realicen de aquí en adelante se debe respetar la ley de la conservación de la masa, por lo tanto SIEMPRE DEBEMOS COMPROBAR QUE LA REACCIÓN ESTÉ BALANCEADA, Y SI NO LO ESTÁ, HACERLO.
EJEMPLOS
1.- Cada uno de los metales alcalinos reaccionan con agua para producir hidrógeno gaseoso y el correspondiente hidróxido del metal alcalino. Una reacción común es la que se da entre el litio y el agua:
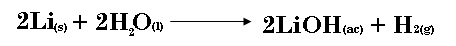
a) ¿Cuántos moles de H2 se pueden formar al completar la reacción de 6.24 moles de Li con agua?
Primero, vamos a asegurarnos que la reacción esté balanceada. En este caso podemos comprobar que así es, ya que tenemos:
2 Li 2
4 H 4
2 O 2

b) ¿Cuántos gramos de H2 se pueden formar mediante la reacción completa de 80.58 g de Li con agua?
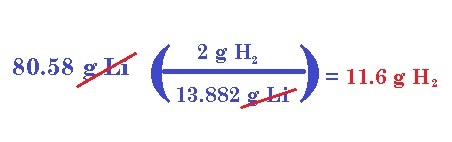
Para este problema, primeramente necesitamos, en vez de los moles, la masa teórica del litio. Un mol de Li pesa, según la tabla periódica, 6.941 gramos, pero en la reacción tenemos 2 moles, por lo cual la masa será 13.882 g. Ahora, según la estequiometría de la reacción, dichos gramos de Li, ¿cuántos gramos de hidrógeno nos produce? 2 g.
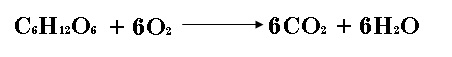
2.- La siguiente reacción representa el complejo proceso de degradación de la glucosa.
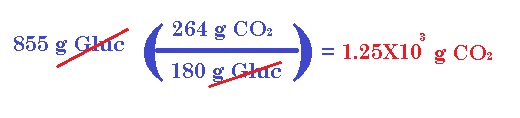
a) Si un cuerpo consume 855 g de glucosa durante cierto periodo, ¿cuál es la masa de bióxido de carbono producida?
Vamos a comenzar obteniendo la masa teórica de la glucosa. Esta sería 180 g, los cuales reaccionan para producir (sacamos la masa teórica del bióxido de carbono y la multiplicación por 6) 264 g de este gas. Procedemos a establecer factores:
ACTIVIDAD. Resolver los siguientes ejercicios.
a) El compuesto cisplatino [Pt(NH2)2Cl2] se ha usado como agente antitumoral. Se prepara mediante la reacción entre tetracloroplatinato de potasio (K2PtCl4) y amoniaco (NH3): 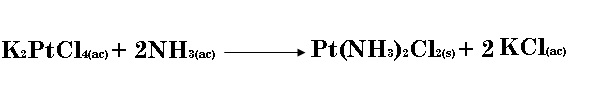 ¿Cuántos gramos de cisplatino se pueden obtener a partir de 0.8865 g de K2PtCl4? Se puede suponer que hay suficiente NH3 para reaccionar con todo el K2PtCl4
|
b) El tetracloruro de silicio (SiCl4) se puede preparar por calentamiento de silicio con cloro gaseoso: 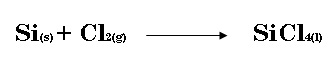 En una reacción se producen, 0.508 moles de SiCl4. ¿Cuántos moles de cloro molecular se usaron en la reacción?
|
c) La fermentación es un proceso químico complejo en el cual la glucosa se transforma en etanol y dióxido de carbono. 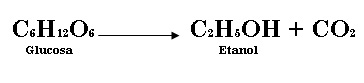 Si se tiene 600.4 g de glucosa al inicio de la reacción, ¿cuál es la cantidad de etanol que se puede obtener?
|