Relaciones de masa de los átomos.
La química es esencialmente una ciencia cuantitativa, es decir, se analiza de forma numérica, con medidas. Comenzaremos por definir que un átomo está conformado por electrones, protones y neutrones.
El número atómico (el cual se representa con la letra Z) es igual a la cantidad de protones que contiene el núcleo del átomo. Debido a que la materia es eléctricamente neutra, se dice que tiene el mismo número de electrones que de protones, por lo tanto, también es el número total de electrones presentes dicho átomo.
Z= p+ = e-
El número de masa (representado por la letra A) es el número total de protones y neutrones presentes en el núcleo de átomo. Muchas veces un mismo átomo no tiene la misma masa, debido a que contiene diferente número de neutrones en su núcleo. A estos átomos de un mismo elemento con igual número de protones, o número atómico, pero con distinto número de masa, se les conoce como isótopos.
Masa atómica promedio.
La masa que contiene la tabla periódica como información no es el número de masa, ya que en gran medida, los átomos naturales no contienen el mismo número de neutrones en su núcleo. Debido a esto, se obtiene lo que se conoce como masa atómica promedio de un elemento mediante la sumatoria de las masas de sus isótopos multiplicados por su abundancia en el planeta y dividido entre 100.
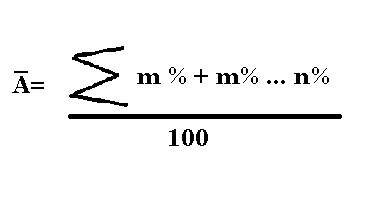
EJEMPLO
1.- El cobre se usa en cables eléctricos y monedas, entre muchas otras cosas. Las masas atómicas de los dos isótopos más estables, 29Cu63 (69.09%) y29Cu65 (30.91%), son 62.93 uma y 64.9278 uma, respectivamente. Calcula la masa atómica promedio del cobre. Los porcentajes que están entre paréntesis indican las abundancias relativas.

Masa molar de un elemento y número de Avogadro.
Debido a que los átomos son demasiado pequeños para poder medir su masa y en el laboratorio se utilizan cantidades con gran número de partículas, se tuvo la necesidad de crear una medida específica para la cantidad de sustancia, la cual en el Sistema Internacional se llamo mol. Un mol se define como la cantidad de sustancia que existe en todas las entidades elementales o partículas que hay en 12 gramos de carbono 12. Esto quiere decir que se tomaron 12 gramos del átomo de carbono y se cuantificaron los átomos que dichos gramos contenían, para establecer la unidad mol. Esto lo hizo Lorenzo Romano Amedeo Carlo Avogadro di Quaregua e di Cerreto (1776-1856), físico y matemático italiano. Avogadro estableció que:
1 mol = 6.022045X1023 partículas
Esta cantidad de partículas se le dio el nombre de Número de Avogadro en honor a su descubridor. Para cálculos en química, este número se redondea a 6.022X1023 partículas.

A partir de estas definiciones, se dice que la masa molar de un elemento es la masa (que puede ser expresada en gramos o kilogramos) de un mol de partículas de dicha sustancia. Es decir, un átomo de hidrógeno pesa 1 uma, su masa molar sería 1 gramo o 1 gramo/mol.
EJEMPLO
1.- El helio (He) es un gas utilizado en la industria, en investigación a bajas temperaturas, en buceo profundo en el mar y en globos. ¿Cuántos moles de helio hay en 6.46 gramos de He?

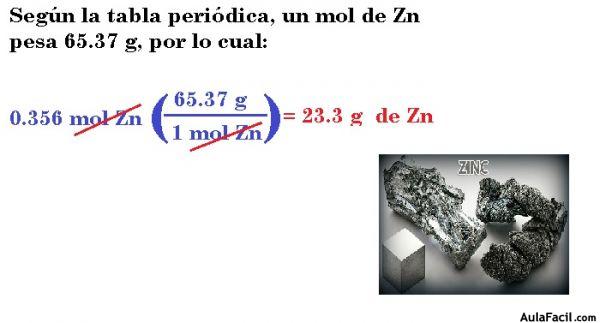
2.- El zinc (Zn) es un metal plateado que se usa para formar el latón (con cobre) y recubrir hierro a fin de prevenir la corrosión. ¿Cuántos gramos hay en 0.356 mol de Zn?
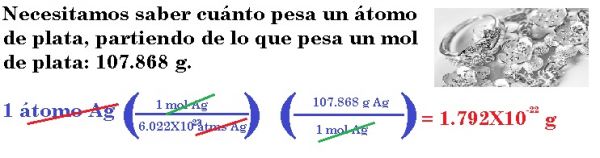
3.- La plata (Ag) es un metal precioso utilizado principalmente en joyería. ¿Cuál es la masa (en gramos) de un átomo de plata?
4.- El azufre (S) es un elemento no metálico. Su presencia en el carbón produce la lluvia ácida. ¿Cuántos átomos hay en 16.3 g de S?

Masa molecular.
Cuando ya conocemos las masas de los átomos u elementos, es momento de conocer la masa de cualquier molécula. La masa molecular es la suma de las masas atómicas de los elementos presentes en una molécula. Se expresa en uma.
EJEMPLOS
1.- Calcular las masas moleculares de los siguientes compuestos.
a) Dióxido de azufre (SO2)
Para la obtención de la masa molecular se puede crear la siguiente tabla:
ELEMENTO | NÚMERO DE ÁTOMOS | Multiplicar | MASA ATÓMICA EN UMA | Es igual a | MASA MOLECULAR PARCIAL |
Azufre (S) | 1 | X | 32 uma | = | 32 uma |
Oxígeno (O) | 2 | X | 16 uma | = | 32 uma |
| Masa molecular total | 64 uma | |||
b) Ácido ascórbico o vitamina C (C6H8O6)
ELEMENTO | NÚMERO DE ÁTOMOS | Multiplicar | MASA ATÓMICA EN UMA | Es igual a | MASA MOLECULAR PARCIAL |
Carbono (C) | 6 | X | 12 uma | = | 72 uma |
Hidrógeno (H) | 8 | X | 1 uma | = | 8 uma |
Oxígeno (O) | 6 | X | 16 uma | = | 96 uma |
| Masa molecular total | 176 uma | |||
2.- El metano (CH4) es el principal componente del gas natural. ¿Cuántos moles de CH4 hay en 6.07 gramos de dicho gas?
Primero obtenemos la masa molecular del metano, como lo hicimos en el ejemplo anterior.
ELEMENTO | NÚMERO DE ÁTOMOS | Multiplicar | MASA ATÓMICA EN UMA | Es igual a | MASA MOLECULAR PARCIAL |
Carbono (C) | 1 | X | 12 uma | = | 12 uma |
Hidrógeno (H) | 4 | X | 1 uma | = | 4 uma |
| Masa molecular total | 16 uma | |||
Lo obtenido se expresa en gramos 16 uma = 16 gramos de metano.

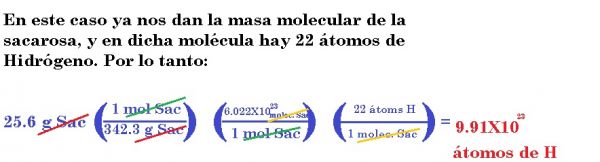
3.- ¿Cuántos átomos de hidrógeno están presentes en 25.6 g de sacarosa o azúcar de mesa (C12H22O11). La masa molar de la sacarosa es de 342.3 g.
ACTIVIDAD. Resolver los siguientes ejercicios.
a) Las masas atómicas de Cl35 (75.53%) y Cl37 (24.47%) son 34.968 uma y 36.956 uma, respectivamente. Calcule la masa atómico promedio del cloruro. Los porcentajes entre paréntesis son las abundancias relativas.
|
b) ¿Cuántos átomos hay en 5.15 moles de azufre?
|
c) ¿Cuántos moles de átomos de cobalto hay en 6.00X109 átomos de Co?
|
d) ¿Cuántos moles de átomos de calcio (Ca) están contenidos en 77.5 g de ese elemento?
|
e) Cierto óxido metálico tiene por fórmula MO. Una muestra de 41.2 g del compuesto se calienta en atmósfera de hidrógeno para eliminar el oxígeno en forma de moléculas de agua. Si el O tiene una masa atómica de 16.00 uma, calcule la masa atómica de M e identifique el elemento.
|
e) Calcule la masa molecular (en uma) de las siguientes sustancias.
|
f) Calcule la masa molar de C55H72MgN4O5 (clorofila), pigmento verde que tienen las plantas y utilizan para la fotosíntesis.
|
h) La densidad del agua es 1.00 g/mL a 4 °C. ¿Cuántas moléculas están presentes en 2.56 mL de agua a esta temperatura?
|
i) Calcule el número de átomos de C, H y O que hay en 1.50 g de glucosa (C6H12O6) en la producción de HgS.
|