Propiedades del agua
La molécula de agua (H2O) está formada por un átomo de oxígeno y dos de hidrógeno unidos por medio de dos enlaces covalentes. Dos de los seis electrones de los orbitales más externos del átomo de oxígeno, intervienen en los enlaces covalentes con los dos átomos de hidrógeno.Como el átomo de oxígeno es más electronegativo que los de hidrógeno, en el lado de los hidrógenos se sitúa la zona de carga positiva y en el del oxígeno la negativa. La unión entre estos tres átomos que forman la molécula de agua, se hace mediante enlaces polarizados que forman entre sí un ángulo de 104,5º.
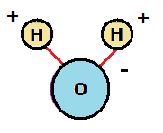
A pesar de que la molécula de agua es neutra tiene carácter bipolar, es decir, se comporta como si por un extremo tuviera carga negativa y por el otro positiva. Esto se debe a que está formada por un elemento electropositivo (el hidrógeno) y otro electronegativo (el oxígeno).
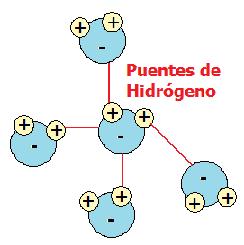
La molécula de agua a su vez tiende a unirse con otras moléculas de agua cercanas, mediante los enlaces conocidos como puentes de hidrógeno que son enlaces de tipo intermolecular débil y de corta duración, por lo que se forman y se destruyen muy rápidamente. Estos se producen por la atracción entre la zona positiva y la negativa de moléculas de agua vecinas, debido a que los cuatro electrones restantes del oxígeno están en pares no enlazados y, por tanto, son excelentes aceptores de enlaces de hidrógeno. Si no fuera por esta atracción, el agua sería una sustancia gaseosa a la temperatura ambiente, de ahí su importancia.
En esta figura se observa como una molécula de agua puede unirse hasta con otras cuatro moléculas de agua diferentes.
El referido carácter bipolar y la unión intermolecular mediante puentes de hidrógeno de las moléculas de agua, le proporcionan a este elemento unas características que lo hacen esencial para la vida, como son:
- Gran capacidad como disolvente: Gracias a la polaridad de su molécula, al agua se le conoce como “disolvente universal”. Se dice que una molécula está polarizada cuando, situada en un campo eléctrico, se orienta por un lado hacia el polo positivo y por otro hacia el negativo. Esto sucede porque, aunque la molécula en su conjunto no tiene carga, la distribución de cargas dentro de la misma no es homogénea, y por este motivo hay una zona que tiene un incremento de carga positiva, mientras otra zona tiene un incremento de carga negativa. Esta característica (presente en el agua) permite que sea un buen disolvente de sales y otras sustancias polares, y sin embargo impide que lo sea de gases y otras sustancias hidrófobas como aceites o grasas.
- Amortiguador de temperatura: Debido a que presenta un elevado calor latente de vaporización y de fusión. El calor latente es la energía necesaria para cambiar de fase una determinada cantidad de una sustancia, ya sea de sólido a líquido (fusión) o de líquido a gaseoso (vaporización). Pues bien, estos valores son más elevados en el agua que en otras sustancias de tamaño similar debido a que (como ya se vio) sus moléculas están unidas por puentes de hidrógeno, para cuya ruptura (necesaria para el cambio de fase) es necesario invertir una elevada cantidad de energía. Al absorber grandes cantidades de “calor”, necesarias para romper los puentes de hidrógeno, la temperatura del agua se eleva muy lentamente ya que para evaporar el agua, primero hay que romper los puentes de hidrógeno y, a continuación, dotar a las moléculas de agua de la suficiente energía cinética como para pasar de la fase líquida a la gaseosa. Esta característica hace que el agua sea un buen almacén de calor y le permite regular la temperatura del planeta y de los seres vivos.
- Elevada tensión superficial y capilaridad: Estas características son consecuencia de la elevada cohesividad que presenta el agua. Debido a su polaridad, las moléculas de agua se atraen entre sí manteniéndose enlazadas unas con otras por medio de los conocidos puentes de hidrógeno, y forman una estructura compacta que la convierte en un líquido casi incompresible. Como consecuencia de ello aparece la tensión superficial, que hace que la superficie del agua presente cierta resistencia a ser traspasada y permite a ciertos insectos caminar sobre ella. Asimismo, gracias a la cohesividad se produce el fenómeno de la capilaridad que permite al agua ascender espontáneamente por estrechos tubos, ya que la cohesión entre sus moléculas es mayor que la adhesión a las paredes del tubo. El agua seguirá subiendo hasta que la tensión superficial sea equilibrada por el peso del líquido que llena el tubo. Esto se traduce en el medio natural hasta el punto de hacer posible el ascenso de la savia en los árboles o el ascenso y descenso del nivel freático.

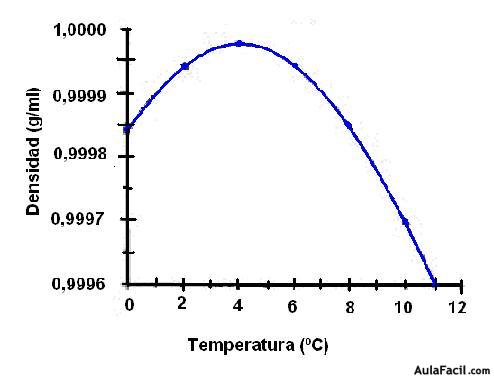
- Densidad y estratificación: La densidad del agua se sitúa en 1.000 g/L, pero varía según las sustancias que lleve disueltas y la temperatura, y ello tiene bastante importancia a nivel ecosistémico, como veremos a continuación, porque la densidad del agua aumenta al disminuir la temperatura hasta llegar a los 4ºC, en los que la densidad alcanza su valor máximo, por debajo de dicha temperatura se produce una disminución de la densidad, debido a lo cual el hielo flota sobre el agua. Esto permite que cuando, por ejemplo, una laguna se congela lo haga sólo en su superficie y de este modo la vida pueda continuar en la masa de agua que queda por abajo, al permanece líquida al quedar aislada. Así, aparecen aguas de diferentes densidades que se colocan como capas que, una sobre otra, funcionan independientemente y a este fenómeno se le conoce con el nombre de estratificación. Pero al no haber intercambio entre estratos el oxígeno y algunos nutrientes se pueden ir agotando en ciertas capas, por lo que la vida por debajo del hielo se desarrolla en condiciones de supervivencia.
- Salinidad: Los iones que proporcionan la salinidad al agua marina tienen dos posibles orígenes, las aguas continentales que arrastran parte del sustrato y el magma que aflora por las dorsales oceánicas.En un litro de agua de mar hay, de media, unos 35 g de sales de los cuales dos terceras partes, aproximadamente, son cloruro de sodio (NaCl). Cuanto más profundo y más abierto esté al océano un determinado mar, más baja será la salinidad del mismo, esto se debe a que sobre él actuará en menor medida la evaporación, al no alcanzarse temperaturas tan elevadas. De este modo, la salinidad en el mar Báltico es más baja que en el mar Mediterráneo. Un caso extremo sería el de los mares interiores, en ellos la salinidad llega a ser muy alta, como en el caso del mar Muerto, donde se alcanzan concentraciones de entre 350 y 370 g de sal por litro. Este hecho sólo le permite estar habitado por especies que viven en condiciones extremas de salinidad, como las plantas halófitas.
Consejo: Poner en el buscador de vídeos “Fin del Mediterráneo”.
- Presión osmótica:Cuando dos soluciones se ponen en contacto a través de una membrana semipermeable, es decir, que permite el paso del disolvente (en este caso el agua) pero no de los solutos (sales), las moléculas de disolvente pasan de manera natural desde la solución con menor concentración de solutos a la de mayor concentración. Este fenómeno se conoce con el nombre de ósmosis y crea, como resultado, una diferencia de presión, entre ambos lados de citada membrana, denominada presión osmótica.La salinidad del agua es una barrera que limita la distribución geográfica de muchos organismos, puesto que las membranas celulares son semipermeables y, por tanto, la absorción de agua salada en determinadas concentraciones y cantidades puede provocar la deshidratación de los tejidos vivos, provocando incluso la muerte (por eso no hay que beber agua del mar).
- Escaso oxígeno disuelto: Una importante limitación para los organismos que viven en el medio acuático, es su pobreza en cuanto a contenido de oxígeno disuelto, pues mientras que la concentración en el aire es de 209 ml/L, en el agua los niveles de oxígeno disuelto típicamente pueden variar entre 7 y 12 mg/L.El oxígeno disuelto es un indicador que marca cómo de contaminada está el agua, si los niveles de oxígeno disuelto son demasiado bajos, los peces y otros organismos no podrán vivir en ella. Parte del oxígeno disuelto proviene de las propias turbulencias que experimenta el agua de río al descender, de la fotosíntesis de las plantas acuáticas, y depende de otras circunstancias como la salinidad (los iones de sal atraen moléculas de agua, lo que deja pocos hidrógenos y oxígenos disponibles para capturar y disociar moléculas de gas, disminuyendo así la cantidad de oxígeno disuelto con el aumento de la salinidad) la altitud (la solubilidad del oxígeno en agua desciende al ganar altura, debido a la disminución de la presión) o la temperatura (el agua fría disuelve mejor el oxígeno, porque mayor temperatura significa mayor agitación en las moléculas, lo que facilita que el gas salga del líquido). Los niveles más bajos de oxígeno disuelto se encuentran normalmente en lugares en los que se acumula materia orgánica en descomposición (depuradoras, granjas, lagos contaminados…) ya que las bacterias necesitan oxígeno para digerir residuos orgánicos y, por tanto, disminuyen su presencia en el agua.


